「免疫グロブリンとは」の版間の差分
Vaccipedia.admin (トーク | 投稿記録) |
Vaccipedia.admin (トーク | 投稿記録) |
||
| (同じ利用者による、間の25版が非表示) | |||
| 1行目: | 1行目: | ||
| + | {{Floating_Menu}} | ||
| + | |||
| + | ==更新履歴== | ||
| + | *2021年7月15日 作成 | ||
| + | *2021年7月18日 一部表現を修正 | ||
| + | |||
==免疫グロブリン immunoglobulin と抗体 antibody== | ==免疫グロブリン immunoglobulin と抗体 antibody== | ||
「抗体 antibody」という用語からは,多くの医療職が下記の構造の分子を思い浮かべることでしょう. | 「抗体 antibody」という用語からは,多くの医療職が下記の構造の分子を思い浮かべることでしょう. | ||
| 95行目: | 101行目: | ||
====IgA の発見と命名==== | ====IgA の発見と命名==== | ||
| − | さらに研究が進み,IgG と IgM | + | さらに研究が進み,IgG と IgM は共にガンマグロブリンおよびベータグロブリンからも発見されました. |
| + | :再々掲:この点でも,「ガンマグロブリン」と「免疫グロブリン」は用語として明確に使い分けるべきです. | ||
| + | 一方で,ガンマおよびベータには「IgG でも IgM でもない免疫グロブリン」が混ざっていることがわかってきました.それらはいったん「β<sub>2A</sub>グロブリン」および「γ<sub>1A</sub>グロブリン」と命名されます. | ||
| − | + | それらは1959年,Heremans らによって新しい単一の免疫グロブリンだと確認され,「IgA」または「α免疫グロブリン」に変名されます.「A/α」が選ばれた理由は,変名当時に確立された命名規則に従ったためのようですが,詳細は不明です. | |
| − | + | :ややこしいのですが,この「α」はアルファグロブリンとは関係ありません.また,アルファグロブリンからは最終的に免疫グロブリンが発見されることはありませんでした. | |
====IgD の発見と命名==== | ====IgD の発見と命名==== | ||
| 202行目: | 210行目: | ||
==分子としての免疫グロブリン immunoglobulin== | ==分子としての免疫グロブリン immunoglobulin== | ||
| − | + | 上述の歴史で発見・命名された5種の免疫グロブリンは,研究の進展により現在では下図のような分子構造を共通して持っていることがわかっています. | |
| + | |||
| + | この図は'''単量体 monomer としての'''構造模式図です. | ||
[[file:Antibody basic unit.svg|400px]] | [[file:Antibody basic unit.svg|400px]] | ||
| 208行目: | 218行目: | ||
左右対称の構造には,H鎖 heavy chain(図の<span style="color:royalblue;">'''青色'''</span>と<span style="color:khaki;">'''黄色'''</span>) と L鎖 light chain(図の<span style="color:lightgreen;">'''緑色'''</span>と<span style="color:hotpink;">'''赤色'''</span>)があります.より長く分子量がより大きい(重い heavy)H鎖は,左右一対で「Y」の字のような形を作っています.より短く分子量がより小さい(軽い light)L鎖は,「Y」の上側を挟むように付いています. | 左右対称の構造には,H鎖 heavy chain(図の<span style="color:royalblue;">'''青色'''</span>と<span style="color:khaki;">'''黄色'''</span>) と L鎖 light chain(図の<span style="color:lightgreen;">'''緑色'''</span>と<span style="color:hotpink;">'''赤色'''</span>)があります.より長く分子量がより大きい(重い heavy)H鎖は,左右一対で「Y」の字のような形を作っています.より短く分子量がより小さい(軽い light)L鎖は,「Y」の上側を挟むように付いています. | ||
| − | === | + | ===抗原結合部位 antigen-binding region,可変領域 variable domain,定常領域 constant domain=== |
| − | + | 冒頭で述べたとおり,「免疫グロブリンという分子」には「抗体という機能」が備わっています.抗体はもちろん抗原に結合する能力を持っています. | |
| + | |||
| + | ではこのY字型の分子のいったいどこに抗原分子は結合するのか? | ||
| + | |||
| + | 上に枝分かれした先の先端2ヵ所に結合するんでしたね. | ||
| + | |||
| + | 先端2ヵ所は図のとおり,H鎖の先端とL鎖の先端の組み合わせで出来ています.組み合わせを「抗原結合部位 antigen-binding region」と呼び,それぞれの先端パーツは図のとおり「V<sub>H</sub>」および「V<sub>L</sub>」と呼ばれます. | ||
| + | |||
| + | 抗原とは外部から侵入する異物ですから,ありとあらゆる形があり得ますね.これらに結合するため,抗体もありとあらゆる形を用意せねばなりません.結合する部位は V<sub>H</sub> と V<sub>L</sub> の組み合わせパーツであり,これらは抗原(のエピトープ)ごとに異なる形で生成されます. | ||
| − | + | 抗原ごとに異なる分子構造で生成される V<sub>H</sub> と V<sub>L</sub> のことを「可変領域 variable domain」と呼びます.「V」は「variable」の頭文字ですね. | |
| − | + | 可変領域に対して,抗原によらず同じ分子構造で生成される部分を「定常領域 constant domain」と呼びます. | |
===H鎖のアイソタイプ isotype=== | ===H鎖のアイソタイプ isotype=== | ||
| − | + | 免疫グロブリンの定常領域は「抗原によらず同じ分子構造」ではありますが,H鎖の定常領域は IgG/M/A/D/E の各クラス間では少しずつ異なっています. | |
| + | |||
| + | IgG/M/A/D/E のクラス間で異なる分子構造を「アイソタイプ」と呼び,ローマンアルファベットに対応するギリシャ文字で呼ばれます.アイソタイプは当然5種類です. | ||
{|class="wikitable | {|class="wikitable | ||
|- | |- | ||
| − | !style="width: | + | !style="width:8em;"|免疫グロブリン<br>クラス |
| + | !style="width:7em;"|H鎖<br>アイソタイプ | ||
|- | |- | ||
| + | |IgG | ||
|γ ガンマ | |γ ガンマ | ||
|- | |- | ||
| + | |IgM | ||
|μ ミュー | |μ ミュー | ||
|- | |- | ||
| + | |IgA | ||
|α アルファ | |α アルファ | ||
|- | |- | ||
| + | |IgD | ||
|δ デルタ | |δ デルタ | ||
|- | |- | ||
| + | |IgE | ||
|ε エプシロン | |ε エプシロン | ||
|} | |} | ||
| − | === | + | ==免疫グロブリンの各クラス同士は何が違うのか?== |
| − | + | 免疫グロブリンは上述の歴史のとおり5種類のクラスが発見され,その分子構造も後に明らかにされました. | |
| + | |||
| + | では,これら5種類はいったい何が違うのでしょうか? | ||
| + | |||
| + | 抗体という機能を果たすためになぜヒトは5種類もの異なる免疫グロブリンを持っているのでしょうか? | ||
| + | |||
| + | どのクラスもヒト血清から発見されましたが,5種類とも血中に混在して漂っているんでしょうか? | ||
| + | |||
| + | 抗原が侵入したらいったいどのクラスが結合しに行くんでしょうか? | ||
| + | |||
| + | そもそも5種類の役割に違いはあるんでしょうか? | ||
| + | |||
| + | |||
| + | 現代免疫学では,5クラスの免疫グロブリンがそれぞれヒト体内の異なる場所で発現され,抗体としてもそれぞれ異なる役割を担っていることを明らかにしています. | ||
| + | |||
| + | 本項は一般的な免疫学の教科書に記載されていることを基にしています. | ||
| + | |||
| + | IgD の機能については,教科書的には「ほとんど不明」ですが,2018年発行の下記論文を参考にしました. | ||
| + | {{Quote|content=[https://onlinelibrary.wiley.com/doi/10.1002/eji.201646547 Gutzeit C, Chen K, Cerutti A. The enigmatic function of IgD: some answers at last. Eur J Immunol. 2018;48(7):1101-1113. doi:10.1002/eji.201646547]}} | ||
| + | |||
| + | ===免疫グロブリンのクラスごとの重合体 polymer=== | ||
| + | 前述の免疫グロブリン模式図は単量体を示しましたが,実際には生体内ではクラスごとに異なる重合体 polymer で存在しています. | ||
| + | |||
| + | 単量体 monomer,二量体 dimer または五量体 pentamer の3種類のいずれかです. | ||
| + | |||
| + | 単量体はさておき,なぜ二量体や五量体を形成する必要があるのか,重合体を形成することに分子としてどのようなメリットがあるのか,サイト管理者が調べた限りではわかりませんでした. | ||
| + | |||
| + | 結合する確率が上がるとか,細胞内移送や細胞膜表現に有利とか,何か分子学的な機序があるんだと想像します. | ||
| + | |||
| + | 具体的には下記のとおりです.なお,IgG/D/E はいずれも単量体ですが,分子構造はそれぞれ少しずつ異なります. | ||
| + | |||
{|class="wikitable | {|class="wikitable | ||
|- | |- | ||
| − | !style="width: | + | !style="width:7em;"|H鎖<br>アイソタイプ |
| − | !style="width: | + | !style="width:8em;"|免疫グロブリン<br>クラス |
| + | !style="width:15em;"|重合体 | ||
|- | |- | ||
| − | |γ ガンマ|| | + | |γ ガンマ |
| + | |IgG | ||
| + | | | ||
| + | *単量体 monomer | ||
|- | |- | ||
| − | | | + | |μ ミュー |
| + | |IgM | ||
| + | | | ||
| + | *分泌型:五量体 pentamer | ||
| + | *B細胞受容体として:単量体 | ||
|- | |- | ||
| − | | | + | |α アルファ |
| + | |IgA | ||
| + | | | ||
| + | *粘膜分泌型:二量体 dimer | ||
| + | *血中分泌型:主として単量体 | ||
|- | |- | ||
| − | |δ デルタ|| | + | |δ デルタ |
| + | |IgD | ||
| + | | | ||
| + | *単量体 monomer | ||
|- | |- | ||
| − | |ε エプシロン|| | + | |ε エプシロン |
| + | |IgE | ||
| + | | | ||
| + | *単量体 monomer | ||
| + | |- | ||
| + | |colspan="3"|[[file:免疫グロブリンクラス (CC BY NC SA 3.0).png|450px]] | ||
|} | |} | ||
| − | + | ===免疫グロブリンのクラスと発現部位および機能=== | |
| + | 前述のとおり免疫グロブリンはクラスごとに異なる重合体で存在しますが,さらに,ヒト体内での発現部位と機能も異なります. | ||
| − | + | 免疫グロブリンを産生する細胞は,B細胞およびその終末分化である形質細胞ですね.よって,免疫グロブリンの発現部位は,B細胞および形質細胞が体内で分布している部位と連動します. | |
| − | + | :B細胞は産生した免疫グロブリンを自らの細胞表面に発現し(細胞膜から生えている状態),免疫グロブリンは抗原に対する受容体として機能します.この場合免疫グロブリンはB細胞受容体 B cell receptor とも呼ばれます. | |
| + | :形質細胞はB細胞が分化成熟したもので,免疫グロブリンを細胞表面でなく細胞外へ分泌(放出)します.分泌された免疫グロブリンは血中や組織内で遊離状態で存在し,侵入する抗原に結合します. | ||
| + | :B細胞も形質細胞も,1つの細胞はただ1種類の特異的な免疫グロブリンを産生します.ヒトが例えば1,000種の抗原に対する抗体すなわち免疫グロブリンを産生できるとしたら,異なる1,000種のB細胞および形質細胞を持っていることになります. | ||
| − | |||
| − | {|class="wikitable | + | |
| + | {|class="wikitable" style="min-width:500px;" | ||
|- | |- | ||
| − | !style="width: | + | !style="width:7em;"|H鎖<br>アイソタイプ |
| − | !style="width: | + | !style="width:8em;"|免疫グロブリン<br>クラス |
| − | !style="width: | + | !style="width:15em;"|重合体 |
| + | !style="width:12em;"|発現部位 | ||
| + | !style="width:20em;"|機能 | ||
|- | |- | ||
| − | |γ ガンマ | + | |γ ガンマ |
| + | |IgG | ||
| + | | | ||
| + | *単量体 monomer | ||
| + | | | ||
| + | *血中 | ||
| + | *胎盤通過(唯一) | ||
| + | *全Ig中75% | ||
| + | | | ||
| + | *病原微生物のオプソニン化および中和 | ||
| + | *補体の活性化 | ||
| + | *抗体依存性細胞障害作用 | ||
| + | *種々の過敏性反応 | ||
|- | |- | ||
| − | | | + | |μ ミュー |
| + | |IgM | ||
| + | | | ||
| + | *分泌型:五量体 pentamer | ||
| + | *B細胞受容体として:単量体 | ||
| + | | | ||
| + | *血中 | ||
| + | *全Ig中10% | ||
| + | | | ||
| + | *抗原刺激に対して最初にB細胞から分泌 | ||
| + | *抗原に対する凝集作用→抗原不動化 | ||
| + | *補体古典経路の活性化 | ||
|- | |- | ||
| − | | | + | |α アルファ |
| + | |IgA | ||
| + | | | ||
| + | *粘膜分泌型:二量体 dimer | ||
| + | *血中分泌型:主として単量体 | ||
| + | | | ||
| + | *粘膜分泌物 | ||
| + | *乳汁 | ||
| + | *全Ig中15% | ||
| + | | | ||
| + | *粘膜上皮細胞にはIgA二量体を粘膜表面へ移送する特殊なレセプターがある | ||
|- | |- | ||
| − | |δ デルタ | + | |δ デルタ |
| + | |IgD | ||
| + | | | ||
| + | *単量体 monomer | ||
| + | | | ||
| + | *血中 | ||
| + | | | ||
| + | *B細胞表面のみに発現 | ||
| + | *実は機能が殆どわかっていない | ||
|- | |- | ||
| − | |ε エプシロン | + | |ε エプシロン |
| − | | | + | |IgE |
| − | | | + | | |
| + | *単量体 monomer | ||
| + | | | ||
| + | *肥満細胞および好塩基球の細胞表面 | ||
| + | *全Ig中0.002% | ||
| + | | | ||
| + | *アレルギーに関与 | ||
| + | **肥満細胞表面に結合したIgE同士を抗原が架橋すると脱顆粒を生じてⅠ型アレルギー | ||
| + | *寄生虫免疫 | ||
|} | |} | ||
2023年9月13日 (水) 16:46時点における最新版
| Navigation Menu |
| General issues of Vaccine | |||||||
|---|---|---|---|---|---|---|---|
|
| General issues of Travel med. | ||||||||
|---|---|---|---|---|---|---|---|---|
|
| Immunology | |||||||
|---|---|---|---|---|---|---|---|
|
| Epi & Stats | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Virus | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| COVID-19 | |||||
|---|---|---|---|---|---|
|
| Bacteria | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Rickettsia | |||||
|---|---|---|---|---|---|
|
| Protozoa | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Fungi | |||||||
|---|---|---|---|---|---|---|---|
|
| Nematode (roundworm) | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Trematode (fluke, distoma) | |||||||
|---|---|---|---|---|---|---|---|
|
| Cestode (tapeworm) | ||||||
|---|---|---|---|---|---|---|
|
| Medical Zoology | ||||||||
|---|---|---|---|---|---|---|---|---|
|
目次
更新履歴
- 2021年7月15日 作成
- 2021年7月18日 一部表現を修正
免疫グロブリン immunoglobulin と抗体 antibody
「抗体 antibody」という用語からは,多くの医療職が下記の構造の分子を思い浮かべることでしょう.
しかし厳密には,物質としての分子を指す場合は「免疫グロブリン immunoglobulin」と呼ぶべきでしょう.
「抗体」とは,何らかの抗原 antigen(の表面の特定のエピトープ epitope)に結合する能力がある免疫グロブリンを指します.
分子の呼称が「免疫グロブリン immunoglobulin」,その抗原(エピトープ)結合機能に目を向けた呼称が「抗体 antibody」と言えるでしょう.
グロブリン globulin とは
そもそもグロブリン globulin とは何でしょう?
Wikipedia記事の引用で恐縮ですが,無数にあるタンパク質を分類する古典的な方法に「球状タンパク質 globular protein」「繊維状タンパク質 fibrous protein」「天然変性タンパク質 disordered protein」「膜タンパク質 membrane protein」の4種があるそうです.何でも19世紀に遡る分類法だそうで.
このうち「球状タンパク質 globular protein」はさらに「グロビン globin」「アルブミン albumin」「アルファグロブリン alpha globulin」「ベータグロブリン beta globulin」「ガンマグロブリン gamma globulin」に分類されます.
「グロブリン globulin」の名称は上位の「球状タンパク質 globular protein」からの派生のようですね.
19世紀~20世紀初頭の化学研究は電気泳動などが主流だったようです.
ヒトの血清を電気泳動したところ,ある程度のかたまりがいくつか観察されたので,ギリシャ文字を使って命名したんですね.アルファは早い段階で1と2に細分化されました.
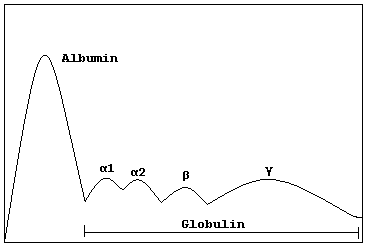
なおこの時代の電気泳動技術では,分子量に従った分別はできなかったようです.つまりアルファ~ガンマは分子量(重さ)順ではありませんし,現代の科学技術では各グロブリンの中に種々の異なる分子量のタンパク質が混ざり合っていることがわかっています.
| タンパク質 | 球状タンパク質 globular protein |
グロビン globin |
|---|---|---|
| アルブミン albumin | ||
| アルファ1グロブリン (α1グロブリン) alpha1 globulin | ||
| アルファ2グロブリン (α2グロブリン) alpha2 globulin | ||
| ベータグロブリン (βグロブリン) beta globulin | ||
| ガンマグロブリン (γグロブリン) gamma globulin | ||
| 繊維状タンパク質 fibrous protein | ||
| 天然変性タンパク質 disordered protein | ||
| 膜タンパク質 membrane protein | ||
そして次項で解説するとおり,ガンマグロブリンが免疫(抗体反応)に強く関わっていることが20世紀の研究で明らかとなりました.
免疫グロブリン発見と分類の歴史
この項では,グロブリンが免疫に関与していると発見された歴史を振り返ります.
以下,こちらの論文を参照しています.
ガンマグロブリン(γグロブリン) gamma globulin の免疫関与の発見
「血清を電気泳動したら何だか分離できたかたまり」であったガンマグロブリンが免疫に関与していることを最初に発見したのは,TiseliusおよびKabatによる1939年の研究だそうです.
彼らは,
- 実験動物にオボアルブミン(卵白の主要アルブミン)を感作させ免疫を獲得させる
- オボアルブミンに免疫獲得した実験動物の血清を抽出し,オボアルブミン溶液に混ぜる
- 混ぜた後の血清を電気泳動したところ,ガンマグロブリンだけが減少していた
という研究観察を行いました.「オボアルブミンに免疫を有する血清中のガンマグロブリンは,オボアルブミンに結合した」,すなわち「ガンマグロブリンは抗原に結合する抗体として働く」ことが明らかとなったのです.
この後で「免疫に関与するグロブリン=免疫グロブリン immunoglobulin」という言葉が生まれ,今日に至るまで「ガンマグロブリン」と「免疫グロブリン」は混同して扱われてきました.
特に,「免疫グロブリンを含む血清由来の製剤」の一般名は現代でも「ガンマグロブリン製剤」で通っています.
しかし次項で示すとおり,アルファグロブリンやベータグロブリンにも免疫グロブリンが含まれることが次第にわかってきました.
よってあくまでも,
- ガンマグロブリン=血清の電気泳動に基づくタンパク質の一分類(製剤の一般名として使われることも)
- 免疫グロブリン =免疫に関与し抗体として作用するグロブリンの機能的分類
と区別すべきですね.
アルファおよびベータグロブリンからの免疫グロブリンの発見
IgM の発見と命名
1944年,Waldenström,Pederson および Kunkel が,多発性骨髄腫の患者の血清から新たな免疫グロブリンを発見しました.
多発性骨髄腫患者の血清を電気泳動したところ,ベータグロブリンのすぐ隣に特異的なかたまりが出現することを発見しました.このかたまりを彼らは「マクログロブリン macroglobulin」と名付けます.
- 「マクロ」というからには,大きめのグロブリンだと考えたんでしょうか?命名由来まではサイト管理者は見つけられませんでした.
後に1960年代に免疫グロブリンの命名法が統一された際に,彼らが分離したマクログロブリンはその頭文字 M をとって「IgM」と名付けられました.「Ig」は「Immunoglobulin」を意味する略語ですね.「IgM」とはいわば「免疫グロブリンM」です.
現代では,多発性骨髄腫はB細胞(Bリンパ球)が腫瘍化して増殖する病態であることがわかっています(B細胞リンパ腫).B細胞とはもちろん抗体を産生する細胞ですね.つまり,現代の分類に従えば,1944年の研究対象だった患者は「IgM型多発性骨髄腫」だったようです.
IgG の命名
1939年の研究で発見された免疫グロブリンは,IgM の命名と時期を同じくして,それを含んでいたガンマグロブリンの頭文字 G をとって「IgG」と命名されました.「G」の由来はガンマグロブリンだったんですね.
- この点でも,「ガンマグロブリン」と「免疫グロブリン」は用語として明確に使い分けるべきです.
IgA の発見と命名
さらに研究が進み,IgG と IgM は共にガンマグロブリンおよびベータグロブリンからも発見されました.
- 再々掲:この点でも,「ガンマグロブリン」と「免疫グロブリン」は用語として明確に使い分けるべきです.
一方で,ガンマおよびベータには「IgG でも IgM でもない免疫グロブリン」が混ざっていることがわかってきました.それらはいったん「β2Aグロブリン」および「γ1Aグロブリン」と命名されます.
それらは1959年,Heremans らによって新しい単一の免疫グロブリンだと確認され,「IgA」または「α免疫グロブリン」に変名されます.「A/α」が選ばれた理由は,変名当時に確立された命名規則に従ったためのようですが,詳細は不明です.
- ややこしいのですが,この「α」はアルファグロブリンとは関係ありません.また,アルファグロブリンからは最終的に免疫グロブリンが発見されることはありませんでした.
IgD の発見と命名
IgA に続く1965年,Rowe と Fahey がやはり多発性骨髄腫患者から,既知の IgG/M/A とは異なる免疫グロブリンをガンマグロブリン中から発見します.
この命名は,「IgA が命名されてるんだからお隣の IgB/βグロブリン にしよう」と当初考えられたようです.しかし同時期に,ネズミの免疫グロブリンを「βグロブリン」と命名する話が持ち上がっていました.そこでB/βを避けることとし,その次の「C」にはギリシャ文字に相当するものがないことから却下され,さらに次の「D/δ」が選ばれたそうです.
- なお,ネズミの免疫グロブリンは結局「βグロブリン」とは命名されずじまいだそうです.仮に命名されていたら,ヒトのベータグロブリンとしばしば混同されて大変だったろうと想像します.
IgE の発見と命名
IgE の明確な同定は IgG/M/A/D に続く1966年のことですが,「アレルギーを持つ個体から別の個体へアレルギーを移植しうる物質」が血清中に存在することは,遡る1890年には既に動物実験で証明されていました.
1966年に Ishizaka, Hornbrook, Johansson が,ブタクサ花粉に含まれる何らかのタンパク質が皮膚に紅斑 erythema を生じうることを発見し,その推定原因物質を紅斑 erythema の頭文字から「抗原E」と名付けました.
それを受けて,Fahey および Rowe が「抗原E」に反応する特異抗体が新たな免疫グロブリンであることを発見し,「IgE」と命名しました.
IgG/M/A/D/E -クラス- の命名由来の整理
以上のような経緯で命名された免疫グロブリンG/M/A/D/Eは,現代では「免疫グロブリンクラス」と呼ばれます.
クラスの命名由来を整理すると,下表のようになります.
| クラス | 命名由来 |
|---|---|
| IgG | ガンマグロブリン gamma globulin の G |
| IgM | 多発性骨髄腫患者血清から分離したマクログロブリン macroglobulin の M |
| IgA | 当時確立された命名規則に従って(詳細不明) |
| IgD | A に続く B にしたかったが他の命名候補と重なりそうかつ C に相当するギリシャ文字がなかったことから消去法で |
| IgE | アレルギーによる紅斑 erythema を生じうる抗原(アレルゲン)に対する免疫グロブリンであるため |
現代の生化学および免疫学によるグロブリンの分類
参考までに,現代の生化学および免疫学では,血清タンパク質は下表のように細分化されています.
※上述のとおり IgG/M/A などは歴史的にガンマグロブリン以外のグロブリンからも分離されていますが,下表は現代の生化学および免疫学に基づく分類です.
| タンパク質 | 球状タンパク質 globular protein |
グロビン globin |
|
|---|---|---|---|
| アルブミン albumin |
| ||
| アルファ1グロブリン (α1グロブリン) alpha1 globulin |
| ||
| アルファ2グロブリン (α2グロブリン) alpha2 globulin |
| ||
| ベータグロブリン (βグロブリン) beta globulin |
| ||
| ガンマグロブリン (γグロブリン) gamma globulin |
| ||
| 繊維状タンパク質 fibrous protein | |||
| 天然変性タンパク質 disordered protein | |||
| 膜タンパク質 membrane protein | |||
分子としての免疫グロブリン immunoglobulin
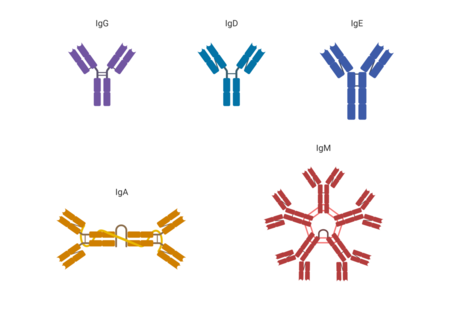
上述の歴史で発見・命名された5種の免疫グロブリンは,研究の進展により現在では下図のような分子構造を共通して持っていることがわかっています.
この図は単量体 monomer としての構造模式図です.
左右対称の構造には,H鎖 heavy chain(図の青色と黄色) と L鎖 light chain(図の緑色と赤色)があります.より長く分子量がより大きい(重い heavy)H鎖は,左右一対で「Y」の字のような形を作っています.より短く分子量がより小さい(軽い light)L鎖は,「Y」の上側を挟むように付いています.
抗原結合部位 antigen-binding region,可変領域 variable domain,定常領域 constant domain
冒頭で述べたとおり,「免疫グロブリンという分子」には「抗体という機能」が備わっています.抗体はもちろん抗原に結合する能力を持っています.
ではこのY字型の分子のいったいどこに抗原分子は結合するのか?
上に枝分かれした先の先端2ヵ所に結合するんでしたね.
先端2ヵ所は図のとおり,H鎖の先端とL鎖の先端の組み合わせで出来ています.組み合わせを「抗原結合部位 antigen-binding region」と呼び,それぞれの先端パーツは図のとおり「VH」および「VL」と呼ばれます.
抗原とは外部から侵入する異物ですから,ありとあらゆる形があり得ますね.これらに結合するため,抗体もありとあらゆる形を用意せねばなりません.結合する部位は VH と VL の組み合わせパーツであり,これらは抗原(のエピトープ)ごとに異なる形で生成されます.
抗原ごとに異なる分子構造で生成される VH と VL のことを「可変領域 variable domain」と呼びます.「V」は「variable」の頭文字ですね.
可変領域に対して,抗原によらず同じ分子構造で生成される部分を「定常領域 constant domain」と呼びます.
H鎖のアイソタイプ isotype
免疫グロブリンの定常領域は「抗原によらず同じ分子構造」ではありますが,H鎖の定常領域は IgG/M/A/D/E の各クラス間では少しずつ異なっています.
IgG/M/A/D/E のクラス間で異なる分子構造を「アイソタイプ」と呼び,ローマンアルファベットに対応するギリシャ文字で呼ばれます.アイソタイプは当然5種類です.
| 免疫グロブリン クラス |
H鎖 アイソタイプ |
|---|---|
| IgG | γ ガンマ |
| IgM | μ ミュー |
| IgA | α アルファ |
| IgD | δ デルタ |
| IgE | ε エプシロン |
免疫グロブリンの各クラス同士は何が違うのか?
免疫グロブリンは上述の歴史のとおり5種類のクラスが発見され,その分子構造も後に明らかにされました.
では,これら5種類はいったい何が違うのでしょうか?
抗体という機能を果たすためになぜヒトは5種類もの異なる免疫グロブリンを持っているのでしょうか?
どのクラスもヒト血清から発見されましたが,5種類とも血中に混在して漂っているんでしょうか?
抗原が侵入したらいったいどのクラスが結合しに行くんでしょうか?
そもそも5種類の役割に違いはあるんでしょうか?
現代免疫学では,5クラスの免疫グロブリンがそれぞれヒト体内の異なる場所で発現され,抗体としてもそれぞれ異なる役割を担っていることを明らかにしています.
本項は一般的な免疫学の教科書に記載されていることを基にしています.
IgD の機能については,教科書的には「ほとんど不明」ですが,2018年発行の下記論文を参考にしました.
免疫グロブリンのクラスごとの重合体 polymer
前述の免疫グロブリン模式図は単量体を示しましたが,実際には生体内ではクラスごとに異なる重合体 polymer で存在しています.
単量体 monomer,二量体 dimer または五量体 pentamer の3種類のいずれかです.
単量体はさておき,なぜ二量体や五量体を形成する必要があるのか,重合体を形成することに分子としてどのようなメリットがあるのか,サイト管理者が調べた限りではわかりませんでした.
結合する確率が上がるとか,細胞内移送や細胞膜表現に有利とか,何か分子学的な機序があるんだと想像します.
具体的には下記のとおりです.なお,IgG/D/E はいずれも単量体ですが,分子構造はそれぞれ少しずつ異なります.
| H鎖 アイソタイプ |
免疫グロブリン クラス |
重合体 |
|---|---|---|
| γ ガンマ | IgG |
|
| μ ミュー | IgM |
|
| α アルファ | IgA |
|
| δ デルタ | IgD |
|
| ε エプシロン | IgE |
|
| ||
免疫グロブリンのクラスと発現部位および機能
前述のとおり免疫グロブリンはクラスごとに異なる重合体で存在しますが,さらに,ヒト体内での発現部位と機能も異なります.
免疫グロブリンを産生する細胞は,B細胞およびその終末分化である形質細胞ですね.よって,免疫グロブリンの発現部位は,B細胞および形質細胞が体内で分布している部位と連動します.
- B細胞は産生した免疫グロブリンを自らの細胞表面に発現し(細胞膜から生えている状態),免疫グロブリンは抗原に対する受容体として機能します.この場合免疫グロブリンはB細胞受容体 B cell receptor とも呼ばれます.
- 形質細胞はB細胞が分化成熟したもので,免疫グロブリンを細胞表面でなく細胞外へ分泌(放出)します.分泌された免疫グロブリンは血中や組織内で遊離状態で存在し,侵入する抗原に結合します.
- B細胞も形質細胞も,1つの細胞はただ1種類の特異的な免疫グロブリンを産生します.ヒトが例えば1,000種の抗原に対する抗体すなわち免疫グロブリンを産生できるとしたら,異なる1,000種のB細胞および形質細胞を持っていることになります.
| H鎖 アイソタイプ |
免疫グロブリン クラス |
重合体 | 発現部位 | 機能 |
|---|---|---|---|---|
| γ ガンマ | IgG |
|
|
|
| μ ミュー | IgM |
|
|
|
| α アルファ | IgA |
|
|
|
| δ デルタ | IgD |
|
|
|
| ε エプシロン | IgE |
|
|
|

